ملخص الكيمياء الكهربية للثانوية العامة في 4 ورقات.. الباب الرابع
ينشر «شبابيك» مذكرة ملخص الكيمياء الكهربية للثانوية العامة، تحتوي على كل ما يحتاج الطالب إلى معرفته قبل دخول اختبار نهاية العام.
ملخص الباب الرابع كيمياء للصف الثالث الثانوي
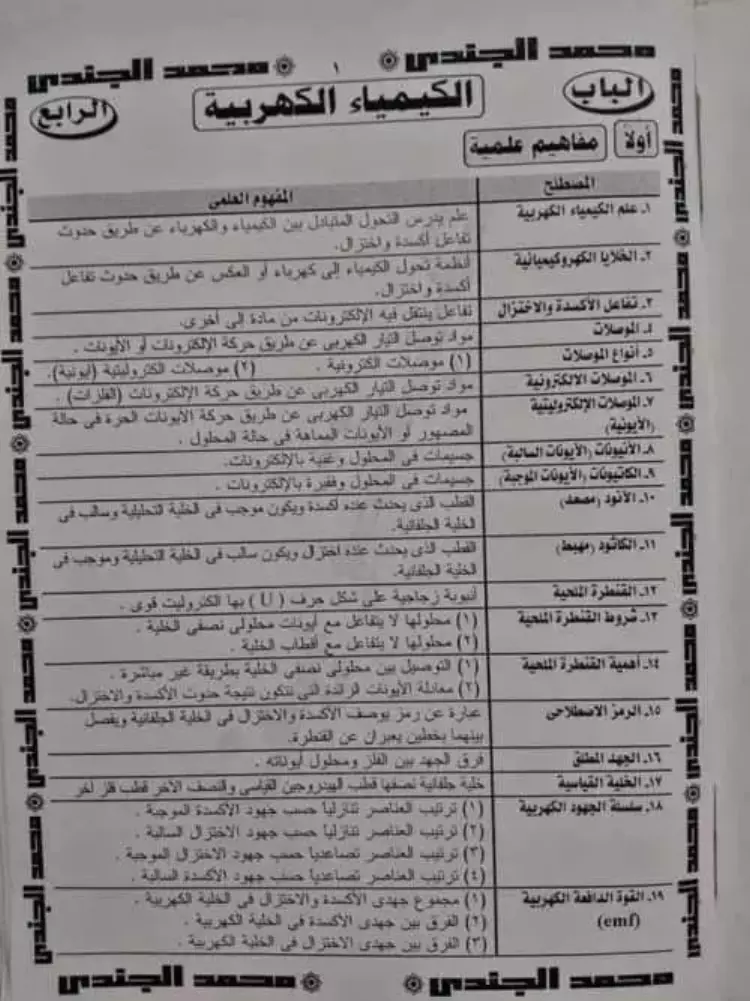
تبدأ المذكرة المرفقة بالأسفل بكل المفاهيم العلمية الموجودة في الباب مدعمة بالقوانين والمعادلات الكيميائية، مثال ما يلي:
-
علم الكيمياء الكهربية: علم يدرس التحول المتبادل بين الكيمياء والكهرباء عن طريق حدوث تفاعل أكسدة واختزال.
-
الخلايا الكهروكيميائية: أنظمة تحول الكيمياء إلى كهرباء أو العكس عن طريق حدوث تفاعل أكسدة واختزال.
-
تفاعلات الأكسدة والاختزال: تفاعل تنتقل فيه الإلكترونات من مادة إلى أخرى.
-
الموصلات: هي مواد توصل التيار الكهربي عن طريق حكة الإلكترونات أو الأيونات.
-
أنواع الموصلات: موصلات إلكترونية – موصلات إلكتروليتية.
-
الموصلات الإلكتروليتية: هي مواد توصل التيار الكهربي عن طريق حركة الأيونات الحرة في حالة المصهور أو الأيونات المماهة في حالة المحلول.
-
الأنيونات: هي الجسيمات في المحلول الغنية بالإلكترونات.
-
الكاتيونات: هي الجسيمات في المحلول الفقيرة بالإلكترونات.
-
الأنود: هو القطب الذي يحدث عنده أكسدة ويكون موجب في الخلية التحليلية وسالي في الخلية الجلفانية.
-
الكاثود: القطب الذي يحدث عنده اختزال ويكون سالب في الخلية التحليلية وموجب في الخلية الجلفانية.
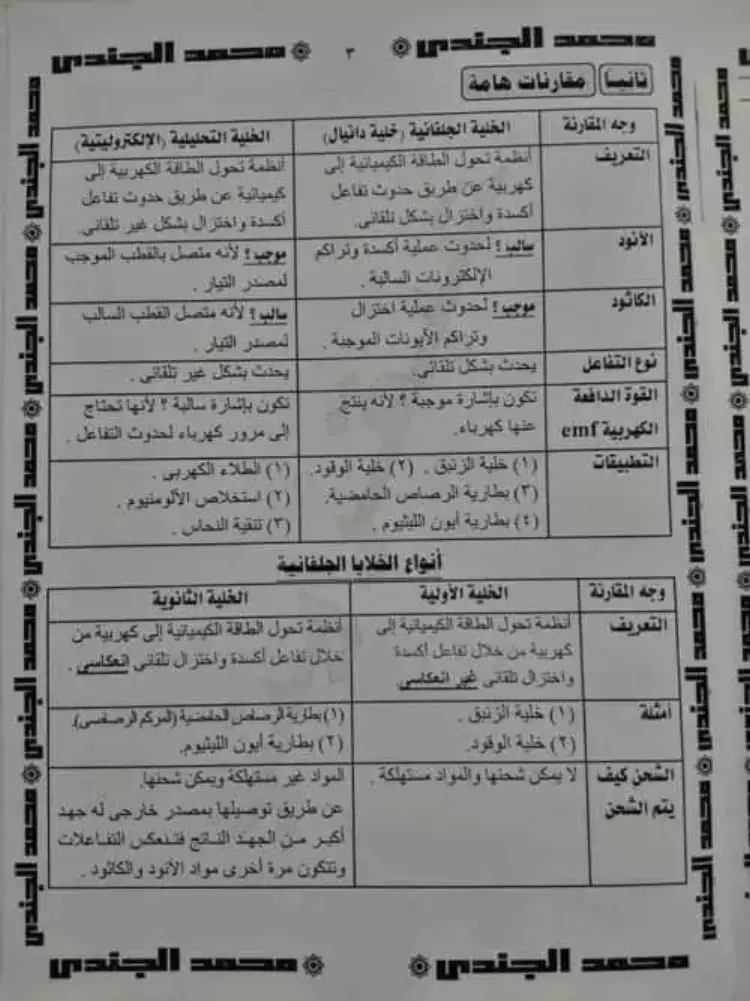
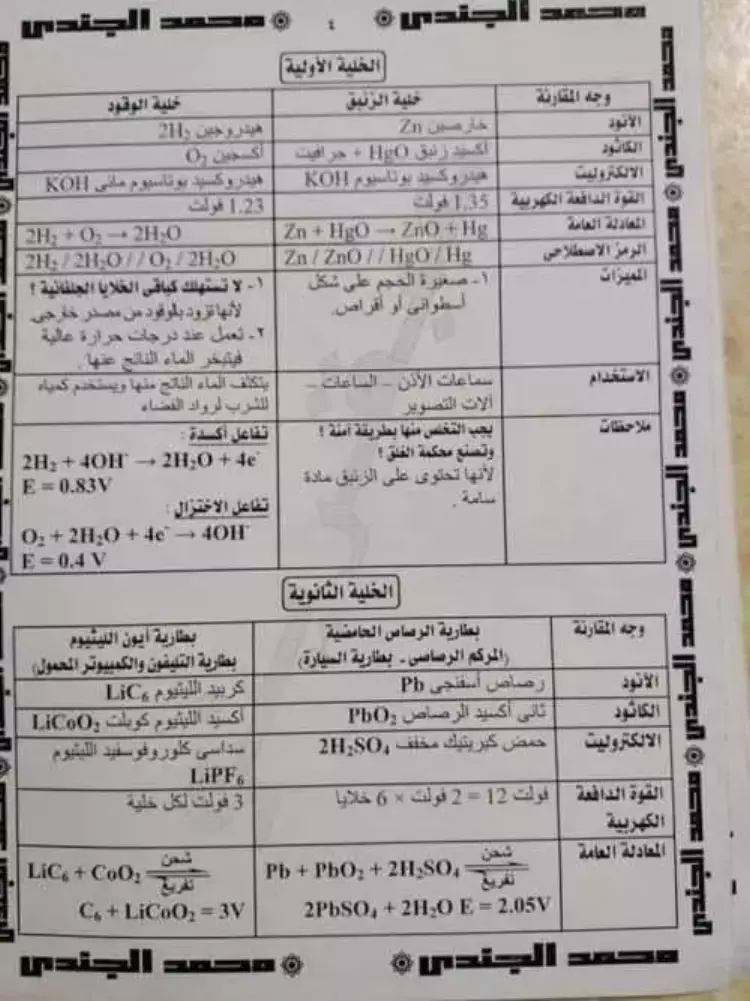
وفي الجزء الثاني من لمذكرة مقارنات تحتوي على أهم المعلومات في باقي المقرر، والتي ترد عليها الأسئلة في الاختبارات، ويمكن الاطلاع عليها كاملة أو تنزيلها والاحتفاظ بها تاليا: